JS001的中文名称正式亮相,为特瑞普利单抗。据君实生物负责人透露,此次获得受理的申请是JS001的新药上市申请,适应症为黑色素瘤。
JS001是国内企业首个获得CFDA 临床试验批件的抗 PD-1单克隆抗体注射液,目前正与国内多家临床中心开展黑色素瘤、鼻咽癌、胃癌、肺癌、食管癌、尿路上皮癌等10余个适应症 I~III 期临床试验。JS001于2018年1月获得FDA临床试验批准,是君实生物首个在全球开展临床试验的生物制品。

在ASCO2017大会上,君实公布过JS001的两项临床数据
——PD1单抗JS001治疗晚期癌症的I期临床结果。ASCO2017#e14581:入组了19例患者,15例患者可评估应答情况,1例霍奇金淋巴瘤完全应答,3例霍奇金淋巴瘤部分应答,1例软组织肉瘤部分应答,1例弥漫性大B细胞淋巴瘤部分应答。3级以上不良反应包括1例肺炎。
——PD1单抗JS001治疗实体瘤的I期临床结果。ASCO2017#3067:入组36例患者(22例黑素瘤、9例尿路上皮细胞癌、5例肾细胞癌),32例患者可评价,1例黑素瘤完全应答,3例黑素瘤部分应答,2例肾细胞癌部分应答,1例尿路上皮细胞癌部分应答,另外10例患者疾病稳定。3级以上不良反应包括1例蛋白尿、2例脂肪酶升高。
特瑞普利单抗(JS001)是国内第4个提交上市申请的PD-1/PD-L1类药物。BMS的nivolumab已经在2017/11/2申报上市,用于二线治疗非小细胞肺癌,并获得了优先审评。信达生物的信迪单抗在2017/12/13提交上市申请,用于治疗霍奇金淋巴瘤。默沙东的帕博利珠单抗在2018/2/11提交了上市申请。
截至目前,全球已有5个PD-1/PD-L1类药物上市,分别是Opdivo(BMS,FDA批准时间2014/12/22)、Keytruda(默沙东,2014/9/4)、Tecentriq(罗氏,2016/5/18)、Imfinzi(阿斯利康,2017/5/1)、Bavencio(默克/辉瑞,2017/5/9)。其季度销售额如下。
PD-1/PD-L1药物全球销售额(亿美元)
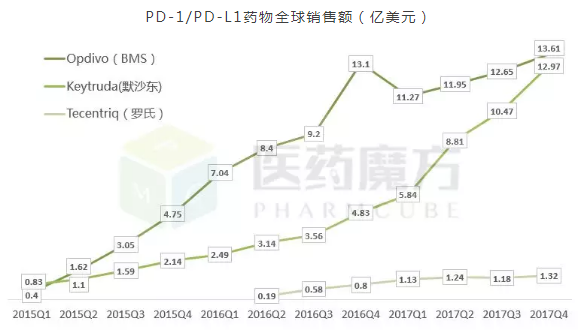
Tecentriq销售额单位为亿瑞士法郎;
国产PD-1/PD-L1类药物的开发竞争也很激烈,目前已经有21个品种陆续向CDE提交了注册申请。
已经向CDE注册的国产PD-1/PD-L1品种





合作咨询
![]() 肖女士
肖女士 ![]() 021-33392297
021-33392297 ![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利) 黑ICP备32063282号-1
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利) 黑ICP备32063282号-1