2019年诺贝尔生理学或医学奖授予哈佛大学的William"Bill" G. Kaelin、牛津大学的利夫Peter J. Ratcliffe和约翰·霍普金斯医学院的Gregg L.Semenza,以表彰他们“在理解细胞感知、适应氧气变化机制中的贡献”。近年来,由Gregg L.Semenza发现的HIF(Hypoxia-Inducible Factor)作为主要的氧气调控因子,科学家围绕HIF做了大量的研究。这次我们就来说一说HIF主要的调节器——脯氨酰羟化酶(prolyl hydroxylase domain,PHD)及其研发管线。
今年的生理学诺获奖者因揭示了低氧信号对生理学机制的重要性而获此殊荣,这一研究为治疗贫血、癌症和许多其他疾病的低氧相关疾病打下了扎实基础。
在聊PHD之前,我们不得不先聊聊HIF,HIF由Semenza等人于1992年发现,它是一种异二聚体转录因子,由一个氧高度敏感因子HIF-α和HIF-β组成。缺氧条件下,HIF-α和HIF-β二聚化进一步激活转录因子p300, 并与缺氧反应元件HRE结合,从而调控多种基因表达,比如红细胞生成, 线粒体代谢和血管生成等。在常氧条件或机体受到损伤时,HIF-α可以被PHD酶羟基化,导致其快速被林希因子VHL识别并被泛素化降解。
常氧条件下,HIF-α脯氨酸残基( Pro402、Pro564、Pro531,Pro490 ,PHD酶催化Pro564的米氏常数Km较低,所以Pro564在HIF调控中占有重要地位)可以被PHD酶羟基化,导致其快速被林希因子VHL识别并被泛素化降解。而在低氧条件下,HIF-α可以避免被羟基化,从而入核与HIF-β二聚化促进下游相关基因的表达,如EPO等。
PHD酶主要包括PHD1、PHD2以及PHD3,其中PHD1主要分布于细胞核中,PHD2分布于细胞质中,PHD3细胞核细胞质中都有分布。PHD是非血红素铁(Ⅱ)依赖的双加氧酶,在氧气、铁和2-OG存在的情况下催化HIF-α的脯氨酸羟基化,羟基化的HIF-α可以被VHL识别并快速的降解。
目前的研究表明,PHD2催化HIF-α羟基化能力较PHD1/PHD3有明显优势,目前,大量的研究都是围绕PHD2展开。基于其内源性配体2-OG,近年来报道了许多竞争性的PHD2小分子抑制剂,其可以将2-OG挤出活性口袋,达到抑制剂PHD2酶活力的目的,从而稳定HIF水平。促进体内促红细胞生成素EPO激素水平升高,达到治疗慢性肾性贫血等疾病的目的。
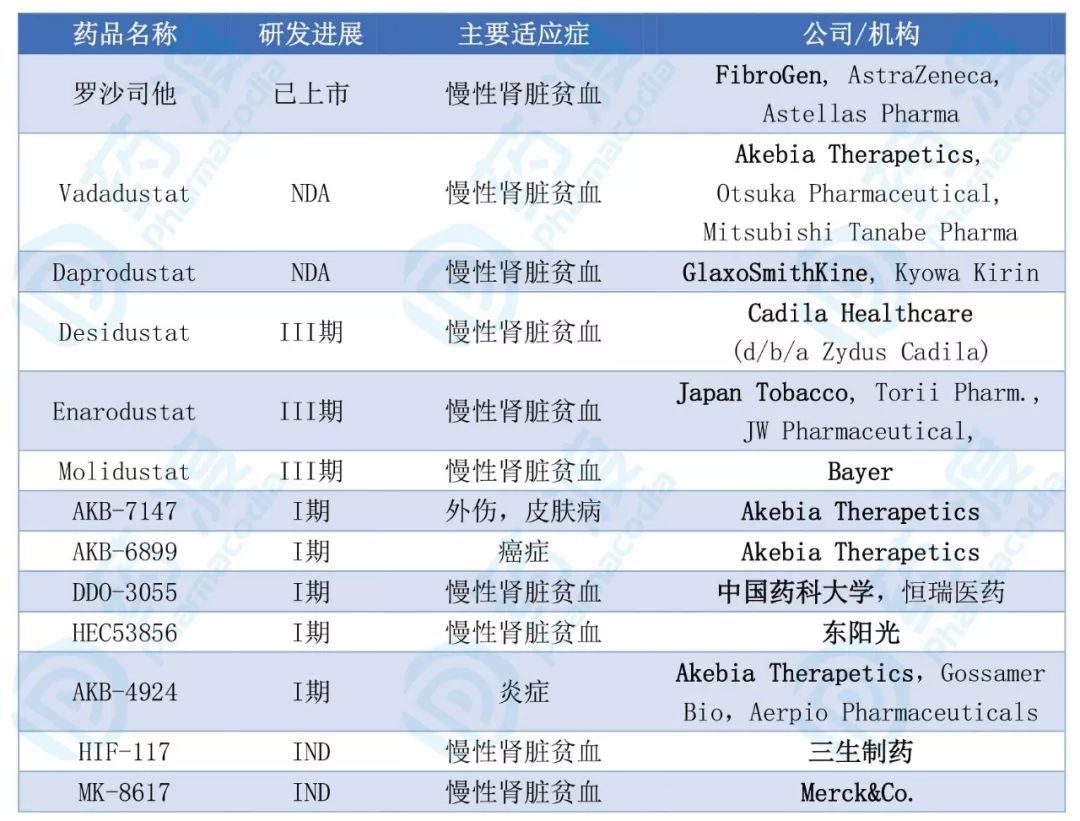
PHD2研发管线
2018年12月,中国国家药品监督管理局(NMPA)通过优先审评审批程序批准由FibroGen发现并与日本药企安斯泰来合作的药罗沙司他胶囊(商品名:爱瑞卓,INN通用名:Roxadustat)上市,用于治疗正在接受透析治疗的患者因慢性肾 脏病(CKD)引起的贫血。
值得一提是,中国是第一个批准罗沙司他的国家,并且罗沙司他是全球首个基于氧感知调控的上市的新药,我国CKD贫血患者也率先受益于诺奖级成果——罗沙司他。2019年7月,上海交大医学院附属医院陈楠教授和复旦大学附属华山医院郝传明教授等在NEJM也公布了罗沙司他两项III期实验结果,主要介绍了长期透析和未经透析的贫血患者使用罗沙司他的治疗效果。
随着第一款口服PHD2小分子抑制剂罗沙司他的上市,PHD2小分子抑制剂正在处于火热的研发中。基于目前处于临床研究的PHD2制剂做一小结(见表1)。
目前,PHD2小分子抑制剂在慢性肾 脏贫血CKD领域竞争激烈,2019年7月,Akebia Therapeutics宣布其合作伙伴田边三菱已向日本厚生劳动省提交了Vadadustat的新药上市申请,用于治疗慢性肾病贫血症。
2019年8月,葛兰素史克已为Daprodustat向日本厚生劳动省递交了新药申请,用于治疗慢性肾 脏疾病导致的贫血。如审批顺利,Vadadustat和Daprodustat将于2020进入市场。
国内制药公司东阳光PHD2小分子抑制剂HEC53856在2018年11月率先拿到临床批件,进入临床I期。由中国药科大学尤启冬教授团队和恒瑞医药联合研发DDO-3055也在2019年4月拿到临床批件,进入临床I期。三生制药新药编号HIF-117也在近期申报临床批件。
随着抗肾 脏贫血药物研发的深入,这一领域内的竞争将变得异常激烈,这也促进我们医药市场更好更快更健康的发展,造福于更多慢性肾病引发贫血的患者。
表1. PHD2小分子抑制剂(排除无进展和终止药物)
结语
HIF作为生理氧调控因子,未来在抗贫血抗癌等方面潜力无限,如何实现更好的调控HIF水平将作为未来科学家的主战场,而PHD毫无疑问是这个战场的主攻阵地,目前科学家们已经取得了一定胜利,期待未来可以传来更多捷报!



合作咨询
 肖女士
肖女士  021-33392297
021-33392297  Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利) 黑ICP备32063282号-1
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利) 黑ICP备32063282号-1