一年一度的美国临床肿瘤学会(ASCO)年会于2024年5月31日至6月4日在芝加哥举行。作为全世界规模最大的肿瘤研究学术盛会,全球肿瘤领域顶尖的科学家、科研机构、制药企业都会通过这个平台将最新研究结果正式公布。石药集团多款产品的多个研究也在此次盛会上精彩亮相。今天,我们对集团明星产品多恩益(盐酸伊立替康脂质体注射液)的研究成果进行整理展示。
背景
FOLFIRINOX(伊立替康+奥沙利铂+5-Fu/LV)为一线治疗标准方案。然而,由于毒性过大,因此FOLFIRINOX通常需要进行调整剂量、延迟治疗和生长因子支持,这会使治疗复杂化。石药集团的伊立替康脂质体(HE072,商品名:多恩益)是一种将伊立替康封装在脂质双层囊泡中的脂质体制剂,于2023年9月12日在中国获准上市,获批的适应症为与5-氟尿嘧啶 (5-FU) 和亚叶酸钙联合用于接受吉西他滨治疗后进展的转移性胰腺癌患者。本研究旨在通过NALIRIFOX(伊立替康脂质体+奥沙利铂+5-Fu/LV)与另一种一线治疗方案白蛋白紫杉醇+吉西他滨 (AG) 进行比较,并证明NALIRIFOX方案安全有效。
研究介绍
该研究是一项针对不可切除的局部晚期或转移性胰腺癌的随机II期研究,比较伊立替康脂质体联合5-氟尿嘧啶/亚叶酸钙和奥沙利铂与白蛋白结合型紫杉醇联合吉西他滨在一线治疗晚期胰腺癌患者的有效性、安全性差异等。
研究设计如下:
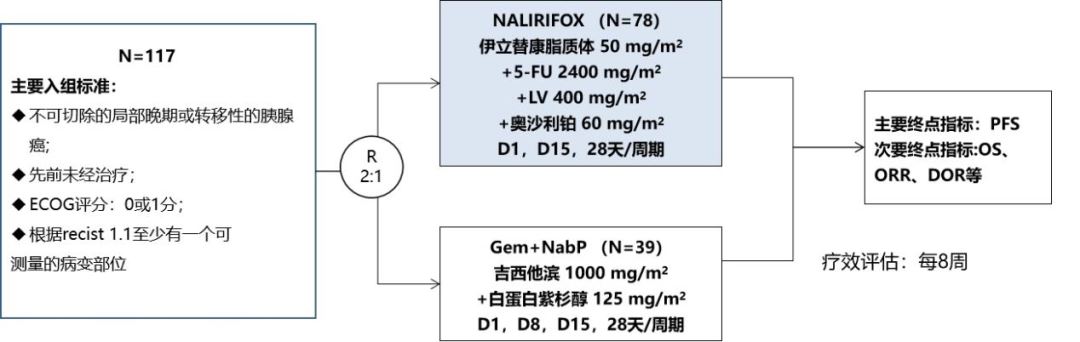
图片来源:石药集团官微
基线人口统计和临床特征
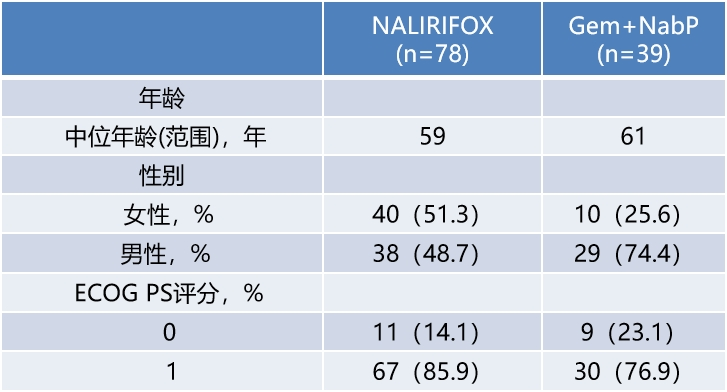
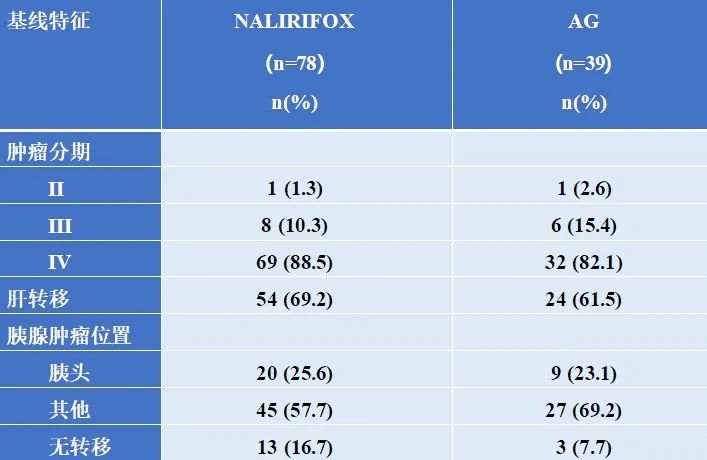
图片来源:石药集团官微
疗效结果
与AG组相比,NALIRIFOX组中位OS延长了4个月(12.9 vs 8.9个月),中位PFS延长了4个月(7.7 vs 3.7个月)。ORR达到了30.8%,DCR达到了73.1%。
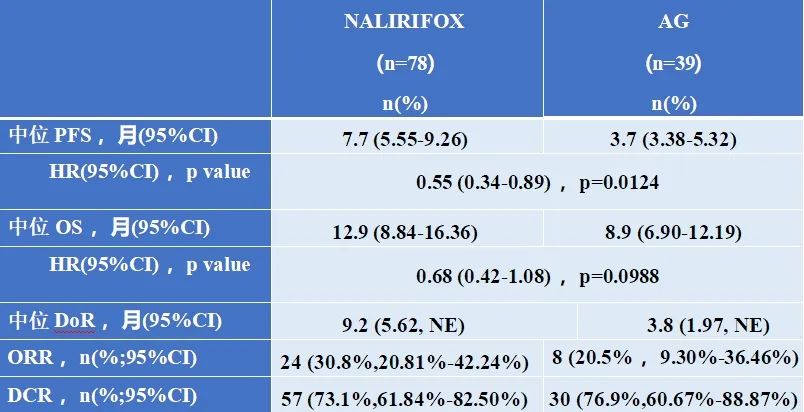
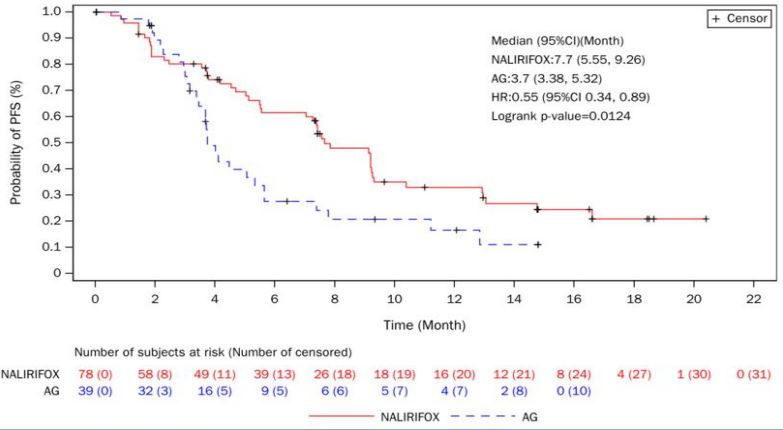
图片来源:石药集团官微
PFS在各亚组均显示出临床疗效获益。
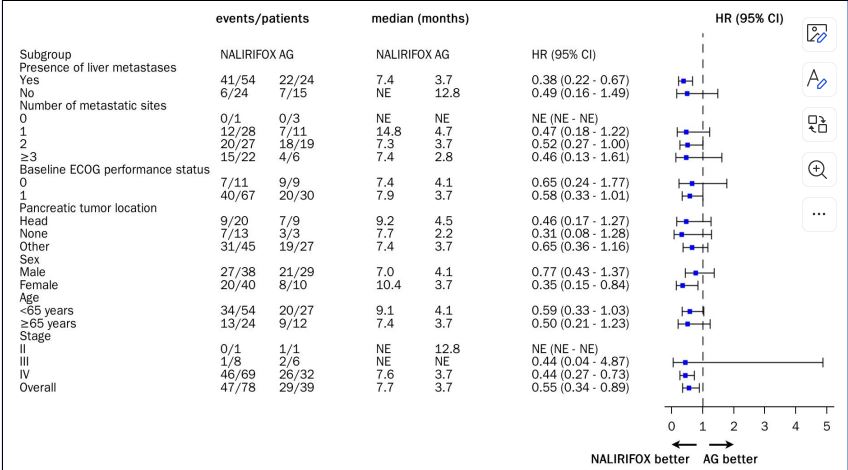
图片来源:石药集团官微
安全性
与AG方案相比,未增加新的安全性风险,整体安全性可控。
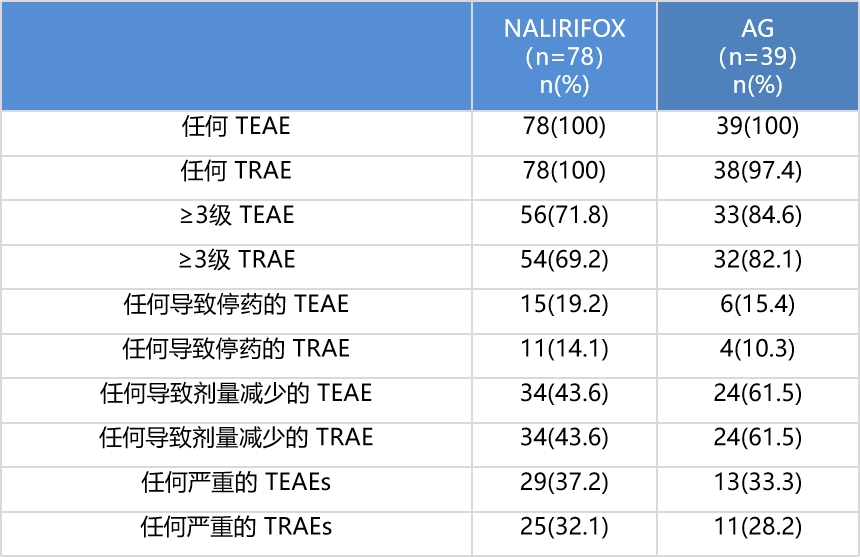
图片来源:石药集团官微
研究结论
该研究达到了PFS的主要终点,显示出统计学意义以及具有临床意义的 PFS 改善,OS 获益趋势。NALIRIFOX与AG相比,安全性与已知的个体毒性的风险一致。这项研究与现有的NAPOLI-3研究一致。
原文如下
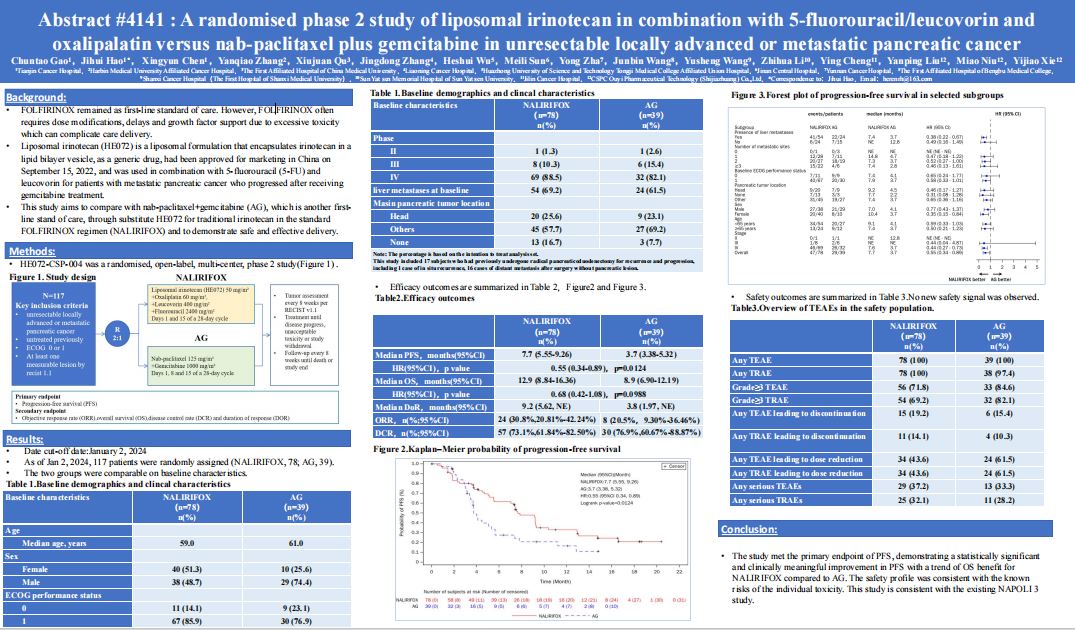
图片来源:石药集团官微
石药集团多恩益2023年9月12日在中国获准上市,获批的适应症为与5-氟尿嘧啶 (5-FU) 和亚叶酸钙联合用于接受吉西他滨治疗后进展的转移性胰腺癌患者。此次重磅临床研究成果在2024年ASCO发布,作为现有的中国人群数据,将为中国胰腺癌患者一线使用NALIRIFOX方案提供更为充分的循证医学证据,标志着消化领域国产药物的研发水平获得国际认可。



合作咨询
 肖女士
肖女士  021-33392297
021-33392297  Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利) 黑ICP备32063282号-1
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利) 黑ICP备32063282号-1