2017年是医药产品创新与公共卫生事业发展具有里程碑意义的一年。在展望2018年之际,我想先回顾一下2017年FDA在药品和公共卫生方面取得的令人振奋的进展-从今年上市的开创性医药产品到创纪录的仿制药批准数量,这一年,FDA既促进了市场竞争,也在推动制定安全和有效的产品创新政策方面作了努力。
如今,新的医药学突破正在深刻地改变我们看待和治疗疾病的方式,而这些突破在几年前甚至难以置信。在现代医药学环境中,FDA全面评估其政策,以确保我们在保护消费者的同时,促进可能有效治疗患者疾病的有益创新,并改善公共健康。”
创新产品破纪录的一年
随着对疾病科学认识的不断提高以及医学实践更加适合患者的个性化需求,FDA也正在实现现代化,例如,在产品整个开发过程中与创新者合作,使用的科学技术更有效地为患者提供产品。
此外,在迅速发展的个体化医药领域,FDA起草新的指南草案,提出了更好的方法来制定解决常常导致或促成疾病的潜在分子变化(例如基因突变)的治疗方案,这包括仅存在于少部分患者中的分子改变。该指南提出了一种方法,当有合理的科学证据表明药物可能对具有这些基因组的患者有效时,药物开发者可以在确诊罕见突变后将患者纳入临床试验中进行靶向治疗。新指南讨论了能够证明不同分子亚型(molecular subsets)药物治疗特定疾病有效性所需的证据。该框架可能促进靶向治疗的发展并使患者从中受益。
在2017年8月,FDA见证了全讯官方网站下载第一个基因治疗产品的批准,治疗疾病的全新方法也随之诞生。接着FDA又批准了另外两种基因治疗药物,此类创新正为治疗严重疾病带来转折,这项技术也可能有助于治愈顽固性和遗传性疾病。2017年,在创新方面也出现了一些其他类似的历史性里程碑事件。这些进步反映了科学的根本转变,使我们能够用新型平台攻克更多疾病。通过更好地开发针对疾病潜在机制的靶向药物,也越来越能够在开发过程中更早地识别患者受益情况。同时,在多数情况下,这些工具也使我们能够更早、更有效地解决安全性问题。
由于这些进步,2017年FDA批准的新型(novel)药物和生物制品创现代记录(56个)。在过去一年批准的56个新型药物中,46个是由药物审评和研究中心(CDER)批准的新分子实体(new molecular entities)- 其中有28个通过一个或多个FDA加速审批程序(expedited review programs)获得批准(图1)。这56个新批准药物中有10个是生物制品审评和研究中心(CBER)批准的生物制品。孤儿药批准数量也创下新纪录。与此同时,FDA解决了未处理的孤儿药认定申请(designation requests)的全部积压。同时,2017年多个月打破了以往FDA单月仿制药批准数量记录,并且创下了FDA历史上年度批准仿制药总数记录(1,027个),包括完全批准(full approvals)和暂时批准(tentative approvals),暂时批准是指不允许申请人销售该仿制药品,并推迟最终批准,直到所有专利/独占期到期(图2)。我们相信,如果继续以目前的趋势发展下去,2018年我们将继续超越这一记录。

图1 2017年新型药物和生物制品批准情况
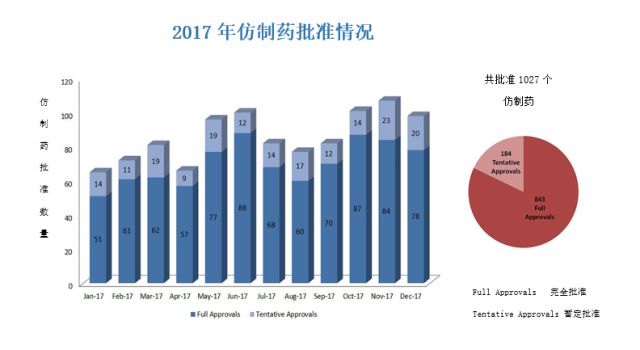
图2 2017年仿制药批准情况
FDA以科学为基础,以患者为中心的监管方式也延伸到医疗器械领域,在此领域专注于产品开发的全生命周期使FDA能够在简化临床开发协议的同时不影响我们依赖严格证据的原则。通过慎重考虑医疗器械上市后如何更好地收集临床数据,而不是通过上市前的研究,使患者在更短的时间内便可使用一些突破性医疗器械,但同时,FDA在证明器械安全性和有效性的合理保证的FDA金标准上不会做任何让步。
FDA承诺采用的以“最简单标准(least burdensome standard)”来获得医疗器械批准关键信息,通过《21世纪治愈法案》中的规定得到加强和推进。这种政策方法是努力帮助创新者提供高质量证据的一个标志,它可以尽可能有效地支持医疗器械上市批准。我们的这些原则增强了药物的可及性。2017年,FDA批准的新型医疗器械数量创纪录—达到了95个,比2009年获批数量的四倍还多(图3)。

图3 新型医疗器械批准情况
使FDA的监管程序现代化
新进展也带来了新的挑战。FDA正面临着对基因治疗,靶向药物,细胞再生药物和数字医疗(digital health)等高新科学领域的监管需求。在这些领域传统的产品监管方法可能不太适合。为了迎接这些新的挑战,FDA正重新审视如何改良惯用的监管方法。我们需要确保允许有利的新技术推进,同时继续把保护消费者作为产品评估程序的一部分。
为了促进这些努力取得成效,FDA推出了新的政策框架,允许某些诊断试验由经过认可的第三方进行审查。这个新框架将减轻试验开发人员的负担,并简化此类创新产品的监管评估程序。新技术试验通常经过常规修改以提高其精确度和临床效用,因此该政策更容易适应这些技术的高度迭代性(highly iterative nature)。
2017年夏天,FDA还启动了一项试点计划,探索监管(regulating)数字医疗器械的新方法,以便通过快速产品评估通道批准快速发展的技术(例如医疗app这类软件工具),尽管FDA有能力确保这些数字健康工具的可靠生产。FDA采用一套指导方针来跟踪这些行动,阐明打算如何以鼓励创新的方式管理数字医疗技术。更广泛地说,FDA允许一些不会对医疗器械安全性或有效性产生显著影响的微小修改无需提交申请,这给低至中等风险的医疗器械制造商提供了便利。因此,患者可以更快地从升级产品中受益。
这项努力使FDA的政策与要审查的新技术的特性恰当匹配,这一点也体现在跨越其他计划的新步骤中(从关于再生医学旨在刺激这些潜在变革性产品的安全和有效创新的全面政策,到对3D打印医疗设备制造商的指导草案中都有体现。)
监管方法现代化所带来的公共卫生收益并不局限于上市前审批程序。如果我们对上市后监管有信心,上市后工具和政策的进步同样可以为患者带来更安全的产品,带来更好的信息指导医疗决策,并有更多机会更有效地将产品推向市场。这就是为什么FDA总是在寻找改革和改善监管方法,并推进与患者和医疗服务提供者分享信息的方式。例如,去年秋天,FDA建立了新的可搜索数据库,以更好地告知患者和医疗服务专业人员药品和生物制品的不良事件报告。FDA将尽快采取其他措施来改进与患者和医疗服务提供者共享重要临床信息的方式。这些目标还包括加大对潜在风险产品的上市后监管的新努力,并将发现的潜在问题提前向消费者发出警告。例如,FDA采取了果断行动,以保护公众免受不道德的诊所( clinics)提供的有风险的干细胞产品的侵害。FDA将在2018年继续采取类似行动。
2017年,FDA还采取了新举措,对虚假声明其未经批准的产品可以治疗或治愈危及生命的疾病的企业做出了警告。FDA制定了一个新的指南草案,描述了FDA对可能给消费者带来风险的顺势疗法产品的监管(regulating)方法;FDA还采取措施提醒公众注意其他未经证实和未经试验的产品的危害,例如某些健身产品(body-building products),受污染的膳食补充剂。FDA还采取新措施促进患者快速获得所需调配药品(compounded medicines,含药房调配制剂和外包场地调配制剂等),同时保护公众免受不良调配药品影响。2018年我们将会实施额外的执法措施,继续推动工作使FDA能够使用真实世界数据更好地为监管决策提供信息。
促进药品竞争
许多人说FDA在药品定价中没有任何作用,我并不同意。尽管FDA没有权力调节价格,但我们确实有权力和责任确保FDA的政策不会阻碍竞争,从而使药品价格不至于过高,增加药品的可及性。
FDA作为具有成本效益和高质量仿制药的守护者,是促进人用和兽用药品竞争的基础力量。FDA正探索帮助患者获得更经济药物的新方法。2017年6月FDA推出的药物竞争行动计划所采取了一些步骤-从仿制药的优先审评,到阻止延缓仿制药进入市场的系统漏洞,在仿制药审查积压方面取得了实质性进展,以确保低成本药物能够以其有效性和更实惠价格造福患者。
打击成瘾性物质的新举措
在我担任局长期间已经多次注意到全讯官方网站下载正面临药物成瘾危机,主要是关于尼古丁和阿 片类药物。2017年,FDA宣布了应对这些危机的新计划。从我作为局长建立阿 片类药物政策指导委员会的第一项重大行动开始,FDA就开始发布各项新行动应对阿 片类药物滥用和成瘾引起的惊人的人力和经济损失。在该委员会的领导下,FDA正在重新评估已经上市的药物的使用情况,包括是否用于正当目的以及是否误用和滥用。
该委员会将推荐新的政策措施来应对这场危机。在需要时FDA会立即采取行动,例如,2017年我们首次将阿 片类止痛药撤市,因为其滥用影响了公众健康。我们还努力寻找减少阿 片类药物使用的方法,防止造成新成瘾性,并支持阿 片类药物使用障碍患者的治疗;例如,通过制定速释阿 片类制剂的新风险评估和缓解策略要求,并要求对标签进行修改,以增加重要澄清信息,说明阿 片类药物使用障碍患者应如何使用药物辅助治疗。FDA正在继续寻求其他创新方法来应对危机,例如对阿 片类药物使用不同形式的包装,储存和处置方法。
保护并发动消费者参与决策
为更好地为公众服务,FDA不仅在医药产品和政策方面进行创新,而且更好地消费者参与决策。对于面临威胁生命或使人虚弱的疾病的患者来说,参与决十分重要。今年,FDA举行了第一次患者参与咨询委员会会议(patient engagement advisory committee meeting)。这是一项开创性的努力,旨在加强我们与患者的接触,并确保患者在监管决策中的声音。
FDA也认识到,在许多严重的疾病中,患者希望更早参与试验性治疗。我们采取了新的措施来改善患者扩大使用(expanded access)可接触资源,包括增强在线扩大使用导航工具,并简化患者参与临床试验性治疗的审批程序。上个月,作为加快罕见疾病药物开发承诺的一部分,FDA发布了指南草案——《儿科罕见病:以戈谢病为例关于药品研发合作方法的行业指南》(Pediatric Rare Diseases —A Collaborative Approach for Drug Development Using Gaucher Disease as a Model Guidance for Industry),描述了不同企业在针对同一特定的超级罕见儿科疾病的同一临床试验中合作形式,同时描述了试验多种药品的可行性新方法,从而减少需要接受安慰剂治疗的患者人数。这一监管方法可以更广泛地应用于其他超级罕见疾病(ultra-rare diseases)。
展望2018年
当我回顾自己担任FDA局长的这八个月时,自从五月份加入FDA以来,我被FDA中专业人员的许多成就所折服。我们在2017年取得了很大的成功。今年我们致力于取得更多进展。2018年FDA在更多的领域里拥有良好前景,FDA 将通过采取新措施来推动有益创新,确保流程高效,人用和兽用产品安全,并实施保护和促进公共健康的实际解决方案。FDA统一日程的启动强调了一些优先事项,包括推进生物类似药政策,现代化推进非处方药发展,和更好地向女性提供有关健康问题和风险因素的信息。
在封闭的环境里不可能有创新。医药学,生物技术,食品科学和整个公共卫生的进步只有在公共卫生集体的合作下才有可能实现。FDA处于独特地位,将来自整个行业(患者,行业,学者,供应商和其他政府机构)的利益相关者聚集在一起,确保创新转化为保护和惠及公众的成果。这是FDA的动力所在,也是我们将在未来一年继续追求的目标。
文章来源
https://blogs.fda.gov/fdavoice/index.php/2018/01/reflections-on-a-landmark-year-for-medical-product-innovation-and-public-health-advances-and-looking-ahead-to-policy-in-2018/



合作咨询
 肖女士
肖女士  021-33392297
021-33392297  Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利) 黑ICP备32063282号-1
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利) 黑ICP备32063282号-1