8月27日,经国家药品监督管理局仿制药质量与疗效一致性评价专家委员会审核确定,发布仿制药参比制剂目录(第二十二批)。本次公布的仿制药参比制剂目录共计507条(比CDE前期公示的增加了12条),共计196个品种;主要包含239条注射剂信息和154条片剂信息。
8月28日,国家药监局药品审评中心(CDE)根据国家局2019年3月28日发布的《关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号),公示了第二十三批参比制剂,共计318条信息,公示期限:2019年8月28日~2019年9月10日。
之前的文章也提到过,同一药品的参比制剂可以来自不同的持证商和不同的国家。目前从公布的参比制剂来看,同一品种参比制剂最多的有4个持证商。分别是拉米夫定片、坎地沙坦酯片、头孢呋辛酯片、茶碱缓释片、唑来膦酸注射液、布洛芬片、阿奇霉素片、双氯芬酸钠缓释片。据统计,目前可以选择2个及以上持证商参比制剂的药品达到208个(其中,可以选择4个持证商的药品品种数量为8个;3个持证商的药品品种数量为31个;2个持证商的药品品种数量为169个)。既然可以选择多个持证商的品种作为参比制剂进行一致性评价研究,企业可考虑从可及性方面选择合适的参比制剂。
下面整体分析一下这22批的1899条信息。
1、整体情况
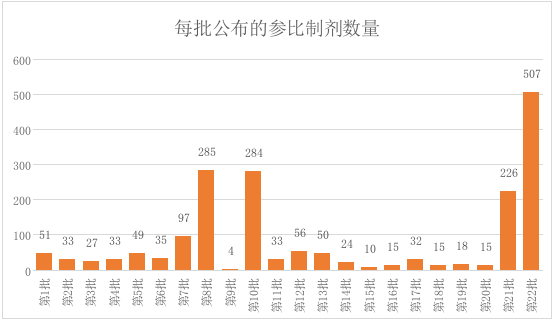
国家药监局分22批公布了参比制剂目录,目前达到1899条,共计917个品种。总的来说,每一批公布的数量没有规律,第22批数量最多,另外还有三个批次数量达到200以上。分析数据可以看出,第22批主要收录的是未进口的原研药品和原研进口药品,第八批和第十批主要公布的是原研进口药品。
2、参比制剂剂型情况
从目前公布的22批参比制剂目录可以看出,目前最多的是片剂,其次是注射剂,第三是胶囊剂,其余剂型数量相对较少,口服固体制剂占据了第一位和第三位。注射剂首次出现在第21批,共计163条,当时掀起了一波业界对注射剂一致性评价的讨论。同时,可以看到在第22批参比制剂目录中,注射剂数量进一步增加,达到239条,占比47.14%。

3、参比制剂持证商
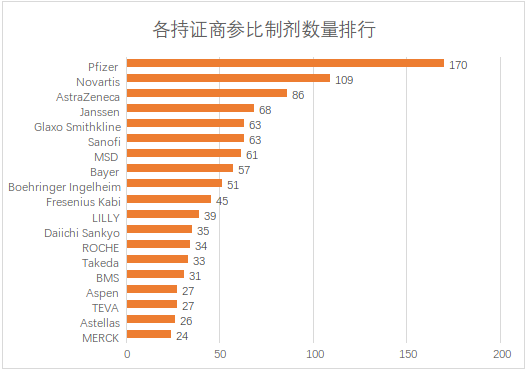
目前拥有参比制剂数量最多的是辉瑞制药,其次是诺华制药(包括山德士),阿斯利康排名第三。排名前三的企业均是新药研发的龙头企业,这也和参比制剂遴选原则比较吻合。
4、参比制剂的来源情况
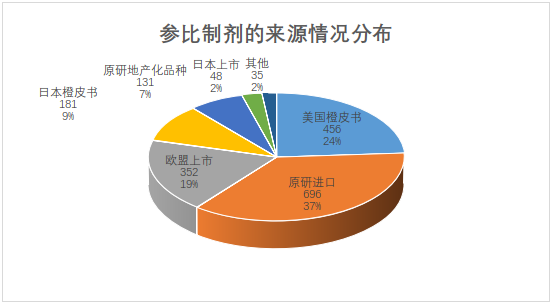
目前仿制药参比制剂目录来源最多的原研进口,其次美国橙皮书,欧盟上市排名第三,符合参比制剂遴选原研进口优先的原则。第11批首次出现了原研地产化品种,第19批首次出现原研技术转移的品种。另外,澳大利亚、加拿大、俄罗斯、土耳其上市的品种也入选了参比制剂目录,可见国家药品监督管理局的工作人员调研范围很广。



合作咨询
 肖女士
肖女士  021-33392297
021-33392297  Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利) 黑ICP备32063282号-1
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利) 黑ICP备32063282号-1